Mais Geral
-


Geral
Paulista e Alto Paulista definem prioridades no Conselho Comunitário
Facebook Twitter WhatsApp Facebook MessengerCom participação de moradores dos bairros Paulista e Alto Paulista (Região 5),...
-


Geral
Arezzo, Ortobom, Verallia e mais; veja empresas que estarão no mutirão de sábado
Facebook Twitter WhatsApp Facebook MessengerEstá procurando emprego? A Prefeitura de Campo Bom vai te ajudar, reunindo...
-


Geral
Moradores de Imigrante Norte e Blumemburg definem prioridades na terceira reunião do Conselho Comunitário
Facebook Twitter WhatsApp Facebook MessengerAconteceu na última terça-feira na Escola Santos Dumont, a reunião do Conselho...
-

Geral
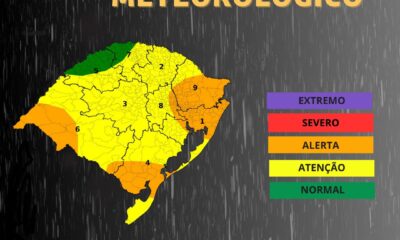
Defesa Civil do estado emite alerta de temporais
Facebook Twitter WhatsApp Facebook MessengerA chegada de um reforço de ar frio deve provocar temporais na...
-


Geral
Dia 10 de abril tem entrega de senhas do Supletivo de Ensino Médio
Facebook Twitter WhatsApp Facebook MessengerAs senhas para os campo-bonenses interessados em prestar exames supletivos do Ensino...